氯化铜是铜(II)的氯化物,化学式为CuCl2。它是黄棕色固体,在空气中缓慢吸收水分生成蓝绿色的二水合物。自然界中氯化铜存在于很稀有的水氯铜矿中。
无水CuCl2为变形碘化镉结构。由于姜-泰勒效应的缘故,涉及一对配体时,一个d电子定域在强反键的分子轨道中,因此大多数铜(II)化合物都与理想的八面体型结构有偏差。在CuCl2(H2O)2中,铜为高度变形的八面体构型,被两个水分子和四个氯离子配体所包围,配体还与其他Cu原子不对称桥联。
氯化铜在水溶液中生成蓝色的2+和黄红色的卤素配离子x-。浓的CuCl2溶液中含有这些带色离子,呈混合色绿色;稀溶液的颜色则与温度有关,100°C时为绿色,室温下为蓝色。 氯化铜在火焰中发出蓝绿色光。
氯化铜为弱的路易斯酸,也是温和的氧化剂。其结构中含有扁平CuCl4的多聚长链。
1000°C时分解为CuCl和Cl2:
氯化铜与盐酸或其他含氯离子的化合物反应,生成配离子CuCl3−和CuCl42−。
某些配离子的盐可以从水溶液中结晶出来,结构可以有很多种:
氯化铜还可与其他很多配体反应生成配合物,例如吡啶或三苯基氧化膦:
但膦一类的“软”配体,如三苯基膦、碘离子、氰离子和一些叔胺,会还原氯化铜得到一价铜配合物。
为了从氯化铜得到一价铜,常用的方法是用二氧化硫还原其水溶液:
CuCl2可提供Cu2+,用于制备不溶的铜(II)盐类。例如氯化铜与氢氧化物反应得到不溶氢氧化铜,在30°C以上分解为氧化铜:
分解反应为:
氯化铜可通过氧化铜、氢氧化铜或碳酸铜与盐酸反应制备:
无水CuCl2可由单质直接化合得到:
用CaCl2-冰浴冷却氯化铜的热稀盐酸溶液可以得到纯净的CuCl2。
工业上主要用氯化铜作为瓦克法中的催化剂,与氯化钯(II)共同催化乙烯转化为乙醛。该法中,PdCl2被还原为Pd,再经CuCl2氧化又得到PdCl2。氯化铜的还原产物CuCl可被通入的空气氧化回CuCl2,从而完成循环。
(1) C2H4(g) + PdCl2(aq) + H2O (l) → CH3CHO (aq) + Pd(s) + 2 HCl(aq)
(2) Pd(s) + 2 CuCl2(aq) → 2 CuCl(s) + PdCl2(aq)
(3) 2 CuCl(s) + 2 HCl(aq) +1/2O2(g) → 2 CuCl2(aq) + H2O(l)
总反应:C2H4 +1/2O2 → CH3CHO
氯化铜在有机合成中也有很广泛的应用。氧化铝存在下,它可以对芳香烃和羰基化合物的α-氢进行氯化:

反应在DMF之类的极性溶剂中进行,且常常加入氯化锂以加快反应速率。
CuCl2在氧气存在下也可氧化酚,主要产物可以是醌或是氧化二聚所得的偶联产物。后者可用于合成1,1-联二萘酚(BINOL)及其衍生物,产率和对映体过量百分数都很高:
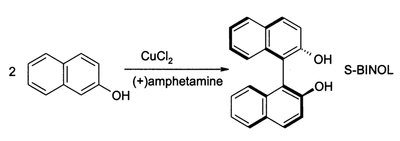
这类化合物是合成BINAP时重要的中间体,其衍生物是不对称氢化反应常用的手性配体。
CuCl2也可催化磺酰氯对烯烃的自由基加成反应,碱存在下产物α-氯代砜可以发生消除得到乙烯基砜。
焰火中用氯化铜来产生蓝绿色光。
