三氯化金,俗称氯化金,是最常见的无机金化合物,化学式是AuCl3。名称中的罗马数字表明金的化合价为+3,这是它众多化合物中最为稳定的价态。金亦会形成另一种氯化物——氯化亚金(AuCl),它没有AuCl3稳定。另外,把金溶于王水便会产生氯金酸,有时也会非正式地称为:“氯化金”、“三氯合金酸”或是“三水合氯化金(III)”。
氯化金(III)吸湿性很强,极易溶于水及乙醇。温度高于160 °C或光照时会分解,并产生多种有大量配体的配合物。
固态和气态的三氯化金都是二聚物;金的溴化物——AuBr3也是如此。两个Au分别位于两个正方平面的中心。此结构称为平面型结构 ,AlCl3及FeCl3也属于这个结构。AuCl3中的化学键主要是共价的,反映了它的高化合价和相对高的电负性。
无水AuCl3在160℃左右分解为AuCl。但后者更高温时会发生歧化反应,生成金属金及AuCl3。
AuCl3是一种路易斯酸,可生成多种加合物,例如:与盐酸反应生成氯金酸(HAuCl4):
三氯化金的水溶液极易与其它金属反应置换出金属金,包括钾、钠等活性大的金属,原因是金的活性序排在很后面(比氢还后面),因此只要排在它前面都能与它置换,例如镁、铝、铜反应式为:
2AuCl3 + 3Mg → 3MgCl2 + 2Au
AuCl3 + Al → AlCl3 + Au
2AuCl3 + 3Cu → 3CuCl2 + 2Au
一些氯化物,例如氯化钾也会与AuCl3反应,生成AuCl4−。
AuCl3溶液与碱(例如氢氧化钠)反应,生成不纯的Au(OH)3沉淀,此沉淀溶于过量的氢氧化钠中生成金酸钠NaAuO2。Au(OH)3受热时,会分解成氧化金(Au2O3),再进一步分解成金属金。
最常用的制备氯化金(III)的方法,是直接在高温中氯化该金属:
三氯化金是最常见的金化合物之一,因此常用作合成许多其他金化合物的起始点。例如:溶于水的氰化物配合物——KAu(CN)4:
金(III)盐,特别是NaAuCl4(由AuCl3与NaCl反应制得),可取代有毒的汞(II)盐作为炔烃反应的催化剂。例如,通过终端炔烃的水合作用来制备甲基酮:
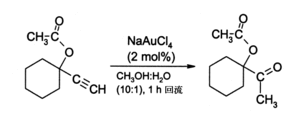
一般在这些条件下,酮的产量可达90%。还有一个用途是在炔烃的胺化反应中作为催化剂。
近年,AuCl3开始引起有机化学家的青睐,因为它可作为其他化学反应的弱酸性催化剂,例如:芳香烃的烷基化反应,以及把呋喃转换成苯酚(见下)。在有机物的合成以及在制药工业中也会用到此化学反应。例如:2-甲基呋喃(斯而烷)可在第5位置与甲基乙烯基酮顺利发生烷基化反应:

常温下,用甲基腈中1 mole%的AuCl3只需进行40分钟的反应便可产生91%的产物。这个产量值得注意,因为呋喃和酮通常在酸性环境下极易发生聚合反应等的副反应。有时当炔烃存在时,会生成苯酚:
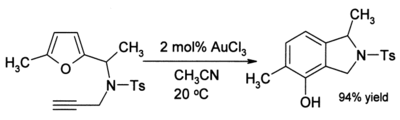
此反应中,碳原子经历了一系列复杂的重排,产生新的芳香环。
处理三氯化金时应戴上手套及护目镜,避免直接接触物料。
