氯化亚铜是铜(I)的氯化物,化学式为CuCl。氯化亚铜为无色固体,常作为制取其他铜化合物的原料。和其他第一列过渡元素的卤化物不同,它可以和一氧化碳形成稳定的配合物。由于铜(I)常形成四面体型配合物,因此氯化亚铜晶体结构为闪锌矿型的。它是微溶于水的白色固体,易溶于浓盐酸,不纯的氯化亚铜样品因混有氯化铜而现绿色。
氯化亚铜是由罗伯特·波义耳在17世纪中叶通过氯化汞和金属铜反应首先合成的 :
1799年约瑟夫·普鲁斯特鉴别出了两种不同的铜的氯化物。他通过将氯化铜在隔绝空气的条件下加热至红热使它失去一半的氯原子,随后用水洗去剩余的氯化铜得到产物。
酸性的氯化亚铜溶液曾用于分析测定气体中的一氧化碳含量,比如用于亨普尔气体发生器(Hempel's gas apparatus)。
附着在铜丝上的白色氯化亚铜晶体
被空气部分氧化的氯化亚铜
相较于其他路易士酸,氯化亚铜较容易取得,毒性也较低。此外,铜的氧化态较多,其中重要的包括+1、+2和+3。氯化亚铜的性质大多与以上两点有关。依照软硬酸碱理论的分类,氯化亚铜为“软酸”,因此较容易和其他归类为“软碱”的路易士碱形成稳定的配合物。以下是氯化亚铜和三苯基膦的反应:
CuCl不溶于水,但可溶于一些特定的溶液中。它与卤化物离子加合生成配离子,例如溶解在浓盐酸中时生成H3O+CuCl2−。含CN−、S2O32−和NH3的溶液也可与CuCl配合而溶解。它也溶于氯化钾或氯化钠等氯化物的浓溶液中。
CuCl在HCl或NH3中的溶液可吸收一氧化碳生成无色的配合物,比如以氯作为桥接配体的二聚体2。而且其盐酸溶液也可与乙炔反应生成,氯化亚铜的氨溶液时则与乙炔反应得到爆炸性的乙炔亚铜(Cu2C2)。CuCl与烯烃的配合物可在溶有烯烃的醇溶液中,用二氧化硫还原CuCl2制得,其中氯化亚铜与二烯烃,如1,5-环辛二烯的配合物相当稳定:
它在水中溶解度不高,而且水溶液不稳定容易歧化,产物为Cu和CuCl2。 因此其溶液常带绿色(如右上图)。
干燥的氯化亚铜在空气中比较稳定,但湿的氯化亚铜在空气中易发生水解和被空气氧化。
氯化亚铜和溴反应,可以得到暗棕色的氯溴化铜(II)(CuBrCl),易溶于水。
实验室制备氯化亚铜可以往热的氯化铜的浓盐酸中加铜屑的方法,再加热溶液至深棕色,稀释后即得氯化亚铜沉淀。
另一种制备方法是向含有铜丝、硝酸、氯化铵、盐酸的溶液中通入氧气并加热,此反应中硝酸为催化剂:
反应结束后,向容器中加入大量水稀释便得氯化亚铜沉淀。
工业上合成氯化亚铜有多种方法。
例如硫酸铜法,向硫酸铜和氯化钠的溶液中通入二氧化硫,再用大量的水稀释。最后洗涤、干燥,即得氯化亚铜产品。反应中温度宜控制在70~80°C,一定要加入过量的氯化钠。初产品要迅速洗涤干燥,以保证产品的产量和质量。
氯化亚铜的主要用途是作为制取杀真菌剂氯氧化铜(王铜)的前体。为达此目的,先利用归中反应制得氯化亚铜水溶液,再以空气氧化:
氯化亚铜可作为很多有机反应的催化剂。氯化铝存在下,它可吸收一氧化碳,被用在合成氨工业上。
在桑德迈尔反应中, 以氯化亚铜处理芳香重氮盐,可得到氯代芳烃:
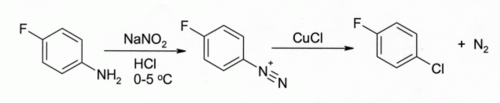
该反应应用很广,产率很高。
早期曾以卤化亚铜来催化格氏试剂对ɑ,β-不饱和酮的1,4-加成, 并从此研究出当今在有机合成中应用很广的有机铜试剂:

例如,CuCl与甲基锂(CH3Li)反应得到吉尔曼试剂——(CH3)2CuLi,常用于有机合成中。这与有氯化亚铜的格氏试剂与α,β-不饱和醛酮的反应类似。尽管碘化亚铜之类的铜(I)化合物也被用于这些反应中,但有些情况下还是选择氯化亚铜:
 Bu = 正丁基
Bu = 正丁基
但在无CuCl存在时,格氏试剂与α,β-不饱和醛酮反应会得到1,2-与1,4-加成产物的混合物,其情况与α,β-不饱键关于羰基另一边的基团有关:当基团为H(即醛基)或较小时,生成的是1,2-加成为主;当基团较大时,生成的是1,4-加成为主
在Gattermann-Koch反应之中,作为催化剂,氯化亚铜吸收气态的一氧化碳。
在Wacker法中,氯化亚铜是反应中由氯化铜形成的中间产物。
在原子转移自由基聚合中,氯化亚铜为催化剂。
